Identificación de los átomos
Los átomos se identifican por el número de protones que
contiene su núcleo, ya que éste es fijo para los átomos de un mismo
elemento. Por ejemplo: Todos los átomos de hidrógeno tienen 1 protón en su
núcleo, todos los átomos de oxígeno tienen 8 protones en su núcleo, todos los
átomos de hierro tienen 26 protones en su núcleo, ..., y esto permite
clasificarlos en la tabla periódica por orden creciente de este número de
protones.
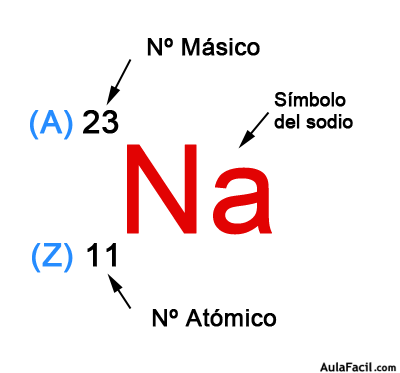
Número atómico: Es el número de protones de un átomo. Se
representa con la letra Z y se escribe como subíndice a la izquierda del
símbolo del elemento: ZX.
Ejemplos: 1H, 8O, 26Fe.
Número másico: Es la suma del número de protones y del
número de neutrones de un átomo. Se representa con la letra A y se escribe como
superíndice a la izquierda del símbolo del elemento: AX.
Ejemplos: 1H, 8O, 26Fe.
De esta manera se pueden identificar el número y tipo de
partículas de un átomo:
31H -----> Este átomo tiene Z = 1 y A = 3. Por
tanto, tiene 1 protón, 3 - 1 = 2 neutrones y, como es neutro, tiene 1 electrón.
Si tenemos un ion habrá que sumar o restar electrones a los
que tendría si el átomo fuese neutro.
- Si es un catión habrá perdido electrones y hay
que restar el número que aparezca con la carga positiva:
2512Mg+2 -----> Este átomo tiene Z = 12 y A = 25.
Por tanto, tiene 12 protones, 25 - 12 = 13 neutrones y, al ser positivo, tendrá
2 electrones menos de los que tendría neutro: 12 - 2 = 10 electrones.
- Si es un anión habrá ganado electrones y hay que
sumar el número que aparezca con la carga negativa:
199F-1 -----> Este átomo tiene Z = 9 y A = 19. Por
tanto, tiene 9 protones, 19 - 9 = 10 neutrones y, al ser negativo, tendrá 1
electrón más de los que tendría si fuese neutro: 9 + 1 = 10 electrones.
Comentarios
Publicar un comentario